Презентация "Скорость химической реакции" по химии – проект, доклад
Презентацию на тему "Скорость химической реакции" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 48 слайд(ов).
Слайды презентации
Список похожих презентаций
Скорость химической реакции
Скорость гомогенной и гетерогенной реакций. Изменение концентрации вещества по мере протекания реакции. Диаграмма изменения внутренней энергии веществ ...Скорость химической реакции. Факторы влияющие на скорость химических реакций
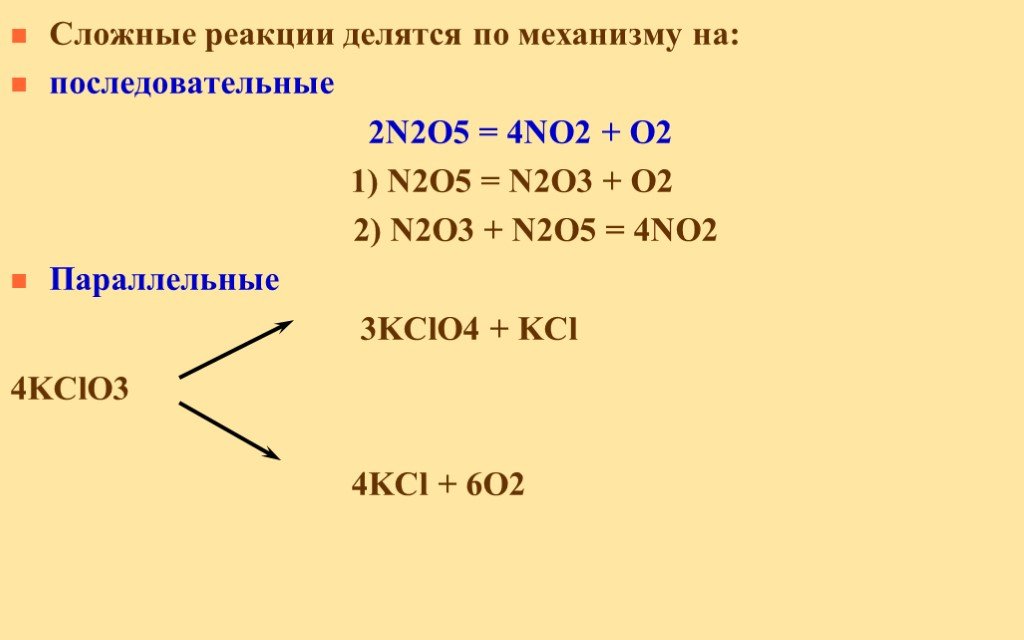
КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИИ ПО ПРИЗНАКУ ФАЗНОСТИ (АГРЕГАТНОЕ СОСТОЯНИЕ). ХИМИЧЕСКИЕ РЕАКЦИИ. ГОМОГЕННЫЕ ГЕТЕРОГЕННЫЕ. (реагирующие вещества и ...Факторы, влияющие на скорость химической реакции
Скорость химических реакций зависит от многих факторов. Основными из них являются: природа и концентрация реагирующих веществ, давление (в реакциях ..."Факторы, влияющие на скорость химической реакции". 11-й класс
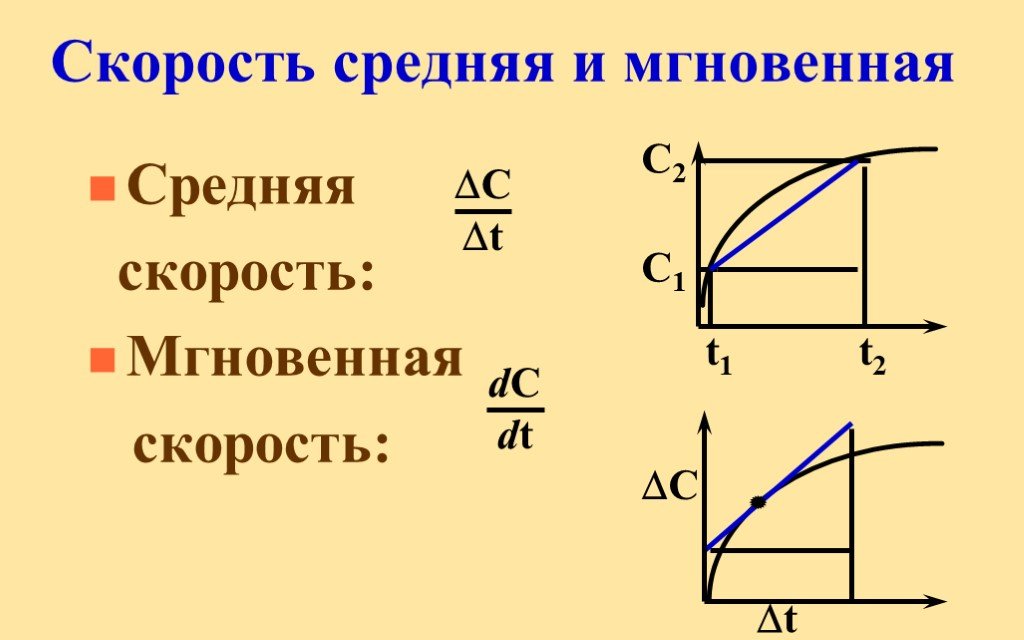
СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ –. отношение изменения концентрации вещества в единицу времени. . КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИИ ПО ПРИЗНАКУ ФАЗНОСТИ ...Влияние условий на скорость химической реакции
Заполните схему с вопросами о скорости реакции:. Задачи урока. Природа реагирующих веществ Концентрация реагирующих веществ Площадь реагирующих веществ ...Скорость химических реакций. Факторы, влияющие на скорость химической реакции
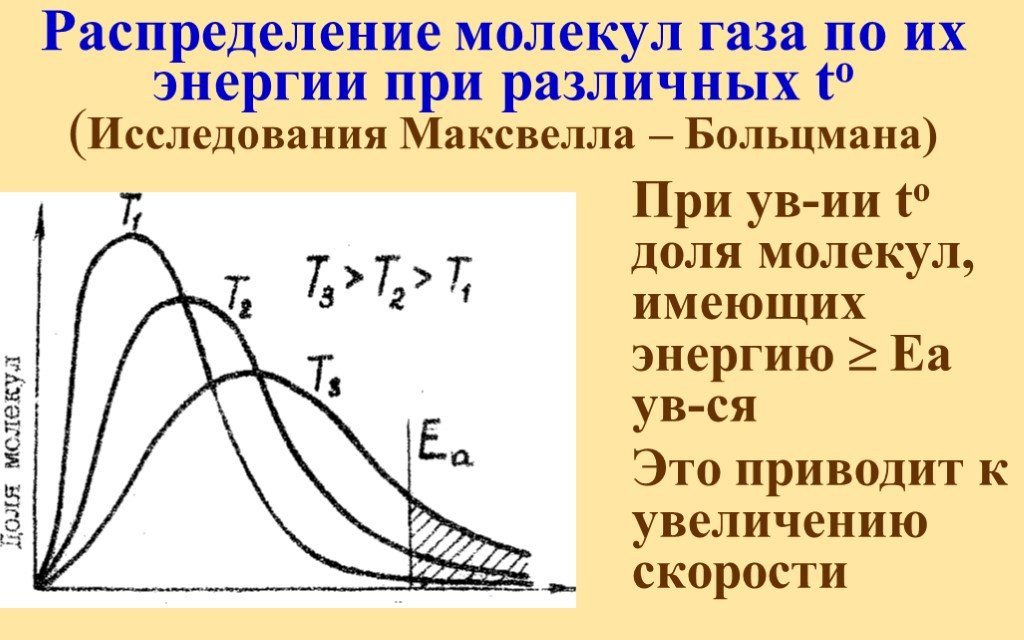
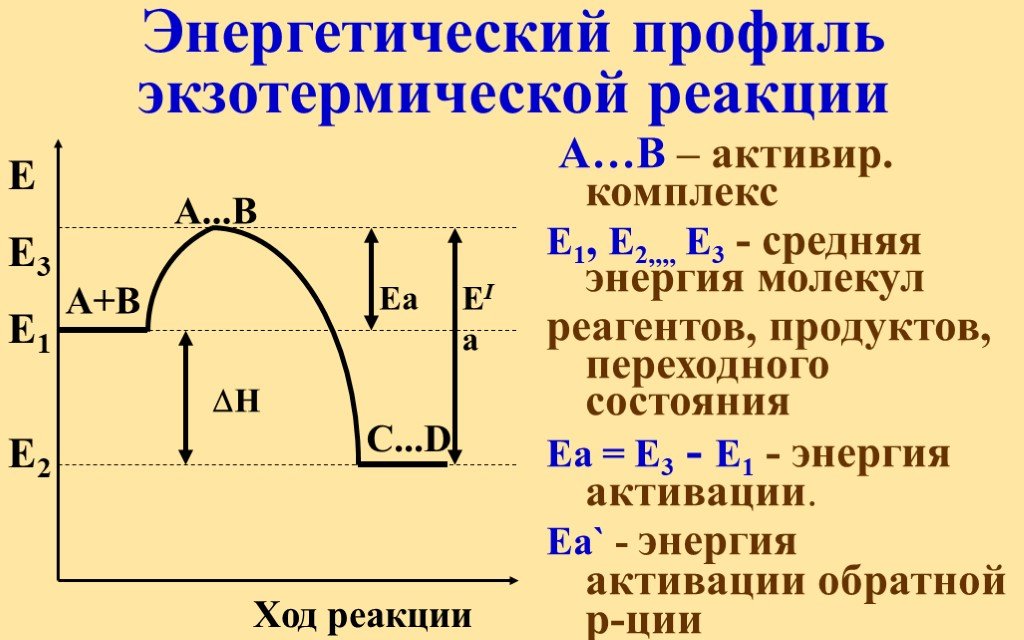
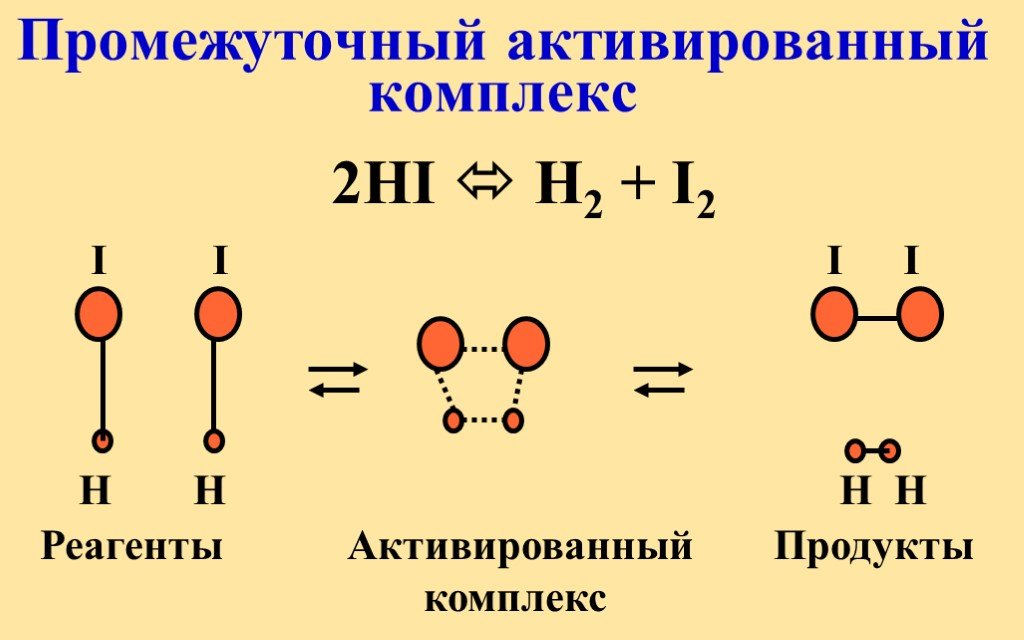
Обсудим следующие вопросы:. Зачем нужны знания о скорости химических реакций? Какими примерами можно подтвердить то, что химические реакции протекают ...Энергия химической реакции
Основные понятия термодинамики. ТЕРМОДИНАМИКА (ТД) – это наука о взаимных превращениях различных видов энергии. Химическая термодинамика изучает:. ...Скорость реакции
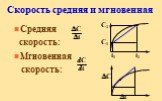
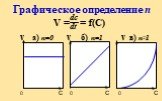
Скорость химической реакции определяется изменением количества реагирующих веществ или продуктов реакции за единицу времени в единице объема (для ...Виды химической связи в неорганических веществах
Знать. определение понятия химическая связь, виды химической связи, механизмы образования каждого вида связи. Уметь. определять вид связи по формуле ...Серелогические реакции
Серологические реакции – это реакции между антигенами и антителами in vitro . Цели применения: серодиагностика бактериальных и вирусных инфекционных ...Химические реакции
План урока. 1. Физические и химические явления. 2. Признаки химических реакций. 3. Условия протекания реакций. 4. Значение химических реакций. Как ...Цветные реакции белков.Качественные реакции на остатки аминокислот.
Указатель реакций. Биуретовая Уравнение реакции Проведение опыта Нингидриновая Ксантопротеиновая Уравнение реакции Проведение опыта Миллона Гопкинса-Коле ...Виды химической связи
Связь между ионами металла и блуждающими электронами называется:. КОВАЛЕНТНОЙ ПОЛЯРНОЙ. ИОННОЙ МЕТАЛЛИЧЕСКОЙ. КОВАЛЕНТНОЙ НЕПОЛЯРНОЙ. 2. Химическая ...Типы химической связи
Ковалентная связь. 1916 г. – теория Льюиса Химическая связь – результат образования общей электронной пары между двумя атомами. Правило октета. Валентный ...Неорганические соединения - формулы и реакции
Цели урока. В игровой форме обобщить и закрепить знания о химических свойствах основных классов неорганических соединений и их взаимопревращениях. ...Окислительно - восстановленные реакции
Окислительно-восстановительные реакции (ОВР) – реакции, сопровождающиеся изменением степени окисления элементов (атомов). Степень окисления (СО) – ...Качественные реакции на ионы металлов
Проблемный вопрос: каким образом можно определить ионы металлов в растворах. Цель работы: научиться определять ионы металлов Задачи: расширить знания ...Некоторые Окислительно-восстановительные реакции алкенов
Правила составления ОВР. Взаимодействия алкенов с водным раствором KMnO4 (реакция Вагнера). При взаимодействии алкенов с водным раствором KMnO4 происходит ...Качественные реакции в органической химии
Алканы. Качественная реакция на алканы: Определить, что какое-то вещество в смеси или в чистом виде алкан, несложно. Для этого газ либо поджигают ...Конспекты
Скорость химической реакции (А20)
Конспект урока на тему «Скорость химической реакции(А20)». 1.При комнатной температуре с наибольшей скоростью протекает реакция между1) Zn и НС1 ...Скорость химической реакции . Факторы, влияющие на скорость химической реакции
Тема урока: «Скорость химической реакции . Факторы, влияющие на скорость химической реакции.». Цели урока. :. -актуализировать и углубить знания ...Факторы, влияющие на скорость химической реакции
Конспект урока по химии в 9 классе. Щеголева Татьяна Александровна. ,. . учитель химии. . высшей категории. МАОУ «Средняя общеобразовательная ...Факторы, влияющие на скорость химической реакции
Тема урока: «Факторы, влияющие на скорость химической реакции». I. . Цели:. Показать влияние различных факторов на скорость химических реакций. ...Факторы, влияющие на скорость химической реакции
МУНИЦИПАЛЬНОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ. СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА № 81. Урок химии в 9 классе. ...Понятие о скорости химической реакции. Катализаторы. Химическое равновесие
Дата_____________ Класс_______________. Тема:. . Понятие о скорости химической реакции. Катализаторы. Химическое равновесие. Цели урока:. повторить ...Скорость химических реакции
Сабақ жоспары №. 6. План учебного занятия. Күні Пән. химия. тобы. Дата Предмет группа. Оқытушының Т.Ә.А. Қайырбекова И. А. . Ф.И.О. преподавателя. ...Уравнения химической реакции
Уравнения химической реакции. Химия 8класс. Мастер-класс. Образовательные задачи:. Обучающие:. Сформировать понятие о химическом уравнении;. ...Обобщение знаний об основных типах химической реакции
. /8 класс/. Тема урока:. Обобщение знаний об основных типах химических реакций. Цель:. Обобщить и закрепить знания о типах ...Физические и химические явления. Химические реакции
Урок химии в 8 классе на тему. :. Физические и химические явления. Химические реакции. . . Савинская Татьяна Андреевна. учитель химии и биологии. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:24 ноября 2018
Категория:Химия
Содержит:48 слайд(ов)
Поделись с друзьями:
Скачать презентацию

















































![Цепные - разветвленные реакции. Н2 + 0,5О2 = Н2О Зарождение цепи: Н2+ О2 = 2ОН Развитие цепи: ОН + Н2 = Н2О + Н Разветвление цепи: Н+О2 = ОН + О О + Н2 = ОН + Н Обрыв цепей: ОН + ОН Н2О2 О + О О2 Обрыв цепи осуществляют ингибиторами [Pb(C2H5)4 , добавляемый в бензин] Цепные - разветвленные реакции. Н2 + 0,5О2 = Н2О Зарождение цепи: Н2+ О2 = 2ОН Развитие цепи: ОН + Н2 = Н2О + Н Разветвление цепи: Н+О2 = ОН + О О + Н2 = ОН + Н Обрыв цепей: ОН + ОН Н2О2 О + О О2 Обрыв цепи осуществляют ингибиторами [Pb(C2H5)4 , добавляемый в бензин]](https://prezentacii.org/upload/cloud/18/11/104849/images/thumbs/screen9.jpg)








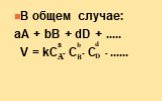



![Пример: Реакцию 2H2(г) + O2(г) = 2H2O(г) провели при одном давлении, а затем при давлении в 10 раз большем. Как изменилась скорость реакции , если кинетическое уравнение сложной цепной реакции имеет вид: V = k [H2]0,4 • [O2]0,3 Решение: При росте Р в 10 раз [H2] и [O2] ув-ся в 10 раз, тогда V1 = k(1 Пример: Реакцию 2H2(г) + O2(г) = 2H2O(г) провели при одном давлении, а затем при давлении в 10 раз большем. Как изменилась скорость реакции , если кинетическое уравнение сложной цепной реакции имеет вид: V = k [H2]0,4 • [O2]0,3 Решение: При росте Р в 10 раз [H2] и [O2] ув-ся в 10 раз, тогда V1 = k(1](https://prezentacii.org/upload/cloud/18/11/104849/images/thumbs/screen24.jpg)
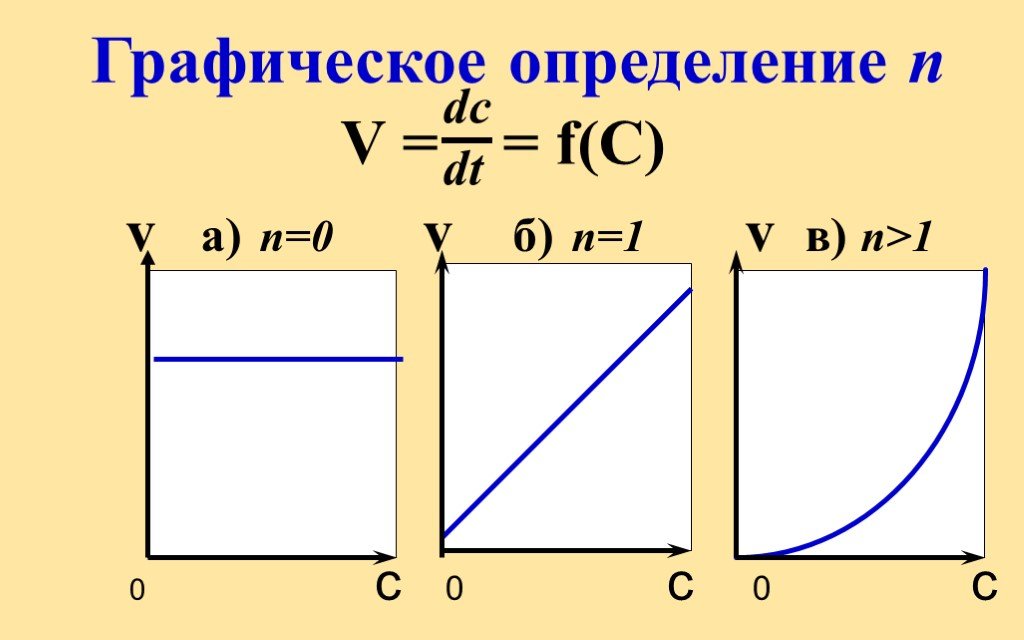
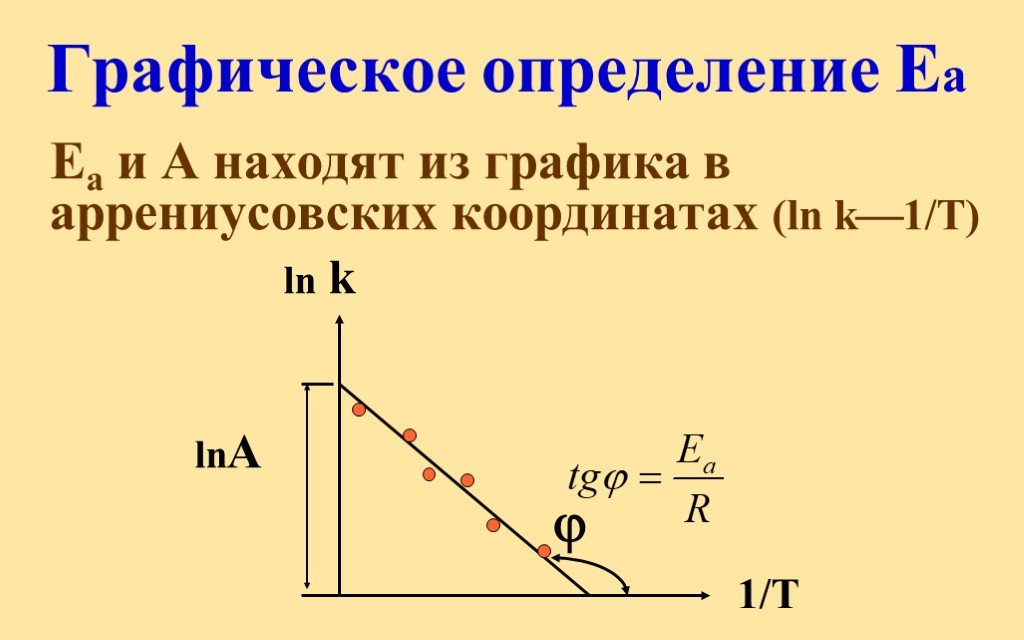
![Константа скорости реакции. Физ. смысл k вытекает из V = k C C При конц-циях реагентов CA = CB = 1 моль/л - это удельная скорость реакции Константа при постоянной to зависит только от природы веществ и не зависит от их концентрации Размерность К n=0, [K] = [моль/лс] n=1, [K] = [1/с] n=2, [K] = [л/ Константа скорости реакции. Физ. смысл k вытекает из V = k C C При конц-циях реагентов CA = CB = 1 моль/л - это удельная скорость реакции Константа при постоянной to зависит только от природы веществ и не зависит от их концентрации Размерность К n=0, [K] = [моль/лс] n=1, [K] = [1/с] n=2, [K] = [л/](https://prezentacii.org/upload/cloud/18/11/104849/images/thumbs/screen25.jpg)



![Константа равновесия с позиции кинетики. Для простой обратимой реакции: аА+bВ сС+dД V = Vпр–Vобр = kпрC C –kобрC C В состоянии равновесия: Vпр = Vобр; kпр[A]a[B]b = kобр[C]c[Д]d. c C Константа равновесия с позиции кинетики. Для простой обратимой реакции: аА+bВ сС+dД V = Vпр–Vобр = kпрC C –kобрC C В состоянии равновесия: Vпр = Vобр; kпр[A]a[B]b = kобр[C]c[Д]d. c C](https://prezentacii.org/upload/cloud/18/11/104849/images/thumbs/screen29.jpg)








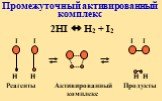
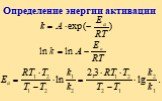





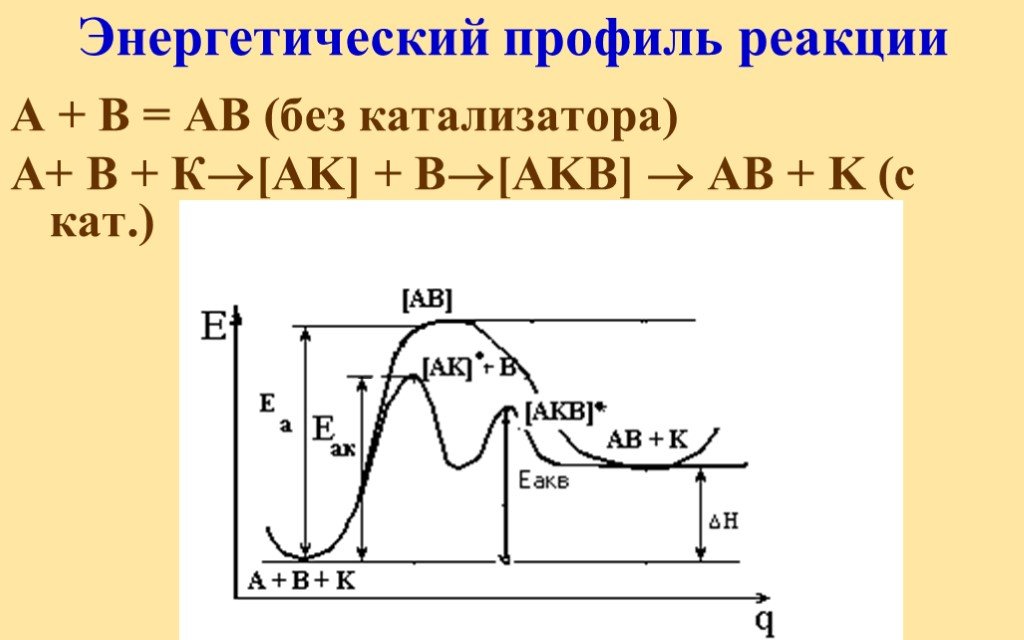
![Энергетический профиль реакции. А + В = АВ (без катализатора) А+ В + К[AK] + В[AKB] AB + K (с кат.) Энергетический профиль реакции. А + В = АВ (без катализатора) А+ В + К[AK] + В[AKB] AB + K (с кат.)](https://prezentacii.org/upload/cloud/18/11/104849/images/thumbs/screen45.jpg)