Презентация "Свойства серы" по химии – проект, доклад
Презентацию на тему "Свойства серы" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 36 слайд(ов).
Слайды презентации
Список похожих презентаций
Химические свойства серы
Цель урока. Охарактеризовать серу в свете трёх форм существования этого химического элемента: в форме атомов, простого вещества, а следовательно, ...Свойства растворов электролитов
Начинаем наш урок, Пригласили к нам в домок, Мы не только всех друзей, И директоров, гостей. Всем хотим мы показать, Как нужно химию нам знать Без ...Свойства полимеров
Широким применением полимеры обязаны своим свойствам, важнейшими из них являются способность к образованию анизотропных высокоориентированных волокон ...Свойства основных классов неорганических соединений
Урок-игра. Девиз: «Все познается в сравнении». Повторение основных понятий темы: ОКСИДЫ, КИСЛОТЫ, ОСНОВАНИЯ, СОЛИ. оксиды Na2O MgO BaO Mn2O7 SiO2 ...Свойства многоатомных спиртов
Содержание. Определение Физические свойства Номенклатура Химические свойства с активными металлами, оксидами активных металлов, с галогеноводородами, ...Свойства металлов
План реферата. Положение металлов в периодической системе Д.И. Менделеева. Строение атомов металлов, кристаллических решеток. Физические свойства ...Токсикологическая характеристика оксидов серы
Физические свойства. SO2 (серистый ангидрид; сернистый газ). SO3 (серный ангидрид). Окси́д се́ры(IV) (диокси́д се́ры, серни́стый газ, серни́стый ангидри́д) ...Свойства электрона
Консультации. Четверг 15-25-18-30 д/з №3635 Методичка к лабораторным работам. Электрон имеет двойственную природу (частица и волна). Движение электрона ...Нефть. Свойства, состав, переработка
Любая попытка дать характеристику такому многогранному дару природы, как нефть, никогда не может быть исчерпывающей. О нефти писали и будут писать. ...Круговорот серы и фосфора
Круговорот серы в природе. Сера играет важную роль в круговороте веществ в биосфере. Соединения серы участвуют в формировании химического состава ...Кислоты. Классификация. Свойства
Определение. КИСЛОТЫ-это сложные вещества, состоящие из атомов водорода и кислотного остатка. Классификация кислот. Названия распространенных кислот. ...Вещество. Свойства веществ
Вещество-это то, из чего состоит физическое тело. Задание. Нарисуйте тела для перечисленных веществ. тело вещество. Стекло Пластмасса древесина. Вещество ...Важнейшие соединения серы
Сероводород выделяется в результате вулканической деятельности, при гниении белков животных и растений, при работе производств химической, текстильной, ...Важнейшие соединения серы
Сероводород выделяется в результате вулканической деятельности, при гниении белков животных и растений, при работе производств химической, текстильной, ...Алюминий, его Свойства и применение
Al 13. Алюминий (лат. Aluminium). 3 8 2 26,9815 3s2 3p1. Был впервые получен датским физиком Х.К. Эрстедом в 1825 г. Название этого элемента происходит ...Свойства тканей из химических волокон
Цели и задачи урока:. Выясним: откуда берутся ткани из химических волокон и что является сырьем для них; какими свойствами обладают эти ткани и где ...Свойства химической связи
Введение. Химическая связь – силы, обуславливающие устойчивое существование двух и многоатомных соединений. В результате образования химической связи: ...Ниобий и тантал. Свойства элементов и их соединений
Общая характеристика Nb и Ta. Основные физичекие характеристики элементов:. Серый металл, мягкий, пластичный (хруп- кий в присутствии ТаН), тугоплавкий, ...Соединения серы
С О Е Д И Н Е Н И Я С Е Р Ы. степень окисления серы -2. Сероводород - Н2S. Сульфиды неметаллов – CS2, P2S3. Сульфиды металлов – Al2S3, K2S. Н2S СЕРОВОДОРОД. ...Оксид серы (IV). Сернистая кислота
Цель урока:. Повторить и закрепить знания учащихся о свойствах кислотных оксидов и кислот. Рассмотреть свойства соединения серы – сернистого газа ...Конспекты
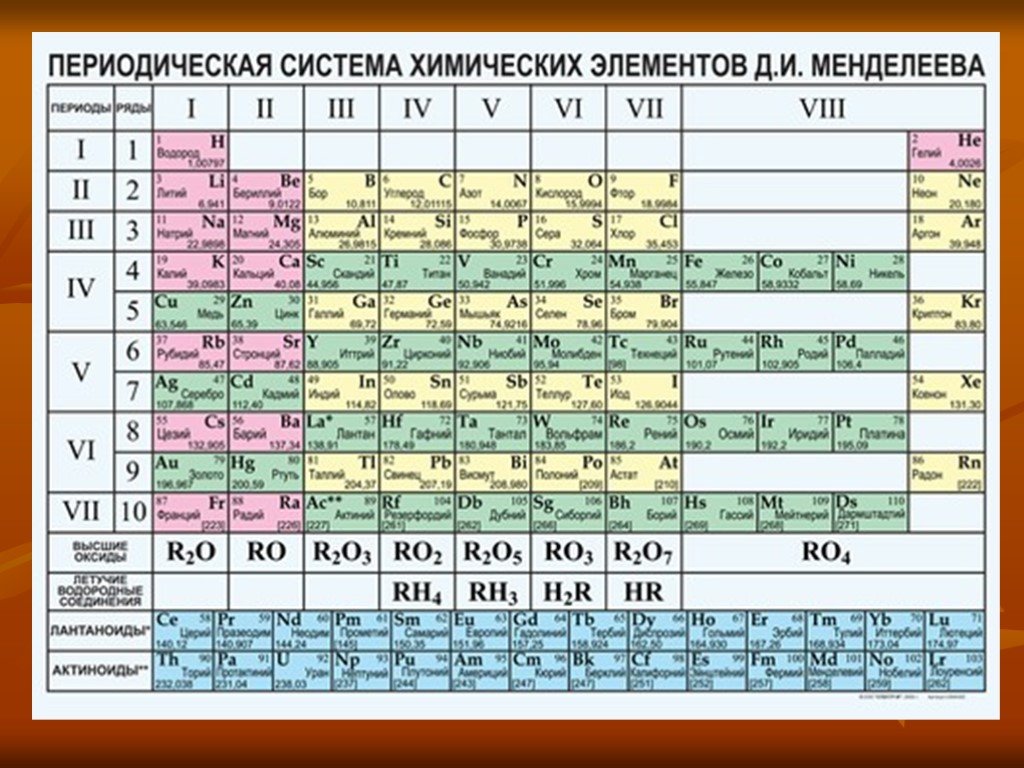
Сера. Положение в ПСХЭ. Свойства серы
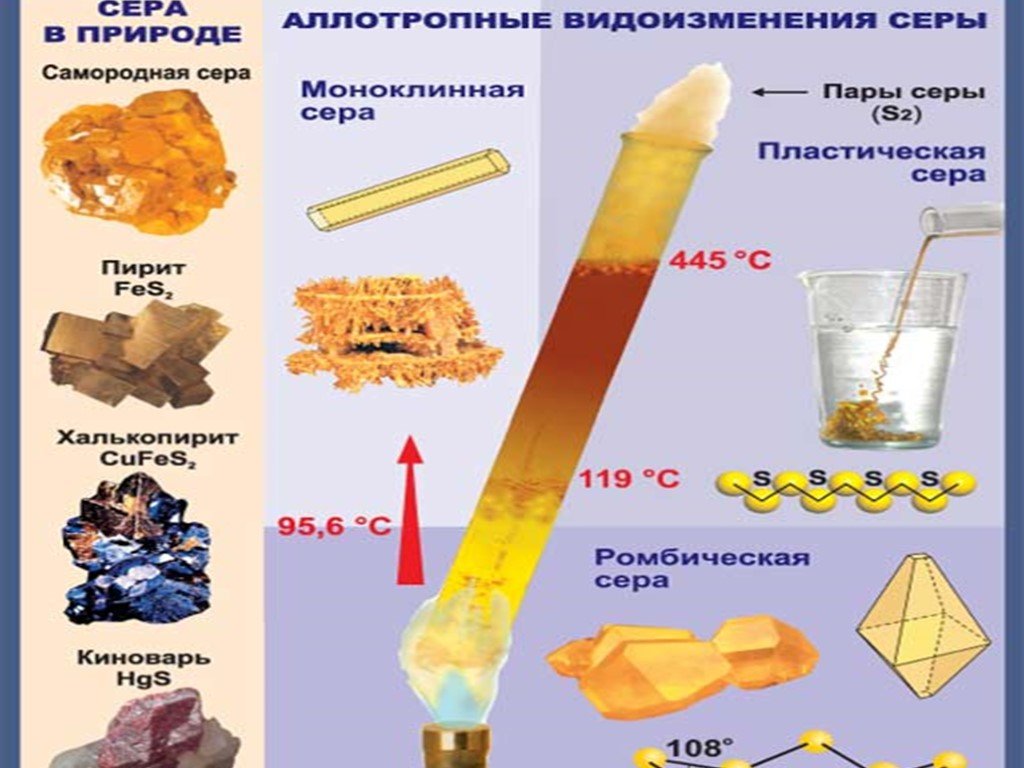
9 класс. Урок 3. Тема:. «Сера. Положение в ПСХЭ. Свойства серы». Цель:. . Образовательная:. актуализация и обобщение знаний учащихся о сере ...Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы
Дата _____________ Класс ___________________. Тема: Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы. Цели урока:. ...Свойства кислот как электролитов
Тема урока " Свойства кислот как электролитов". . Тип урока:. урок открытия новых знаний. Цель: создать условия для полноценного восприятия ...Свойства кислорода
Свойства кислорода. Цель урока. Обучающие :. способствовать формированию знаний учащихся о кислороде, его химических свойствах;. . реакция ...Свойства ионов. Качественные реакции на катионы и анионы
Сидорина Г. Н. , учитель химии. . Г У. Средняя общеобразовательная школа. N. 0. 5, г. Актау. . . Тема урока: «Свойства ионов. Качественные ...Железо. Свойства железа и области применения
МКОУ «Буткинская общеобразовательная школа». Учитель химии: Шарова Л. С. . . Железо. Свойства железа и области применения. (9 класс). Цели ...Свойства углеводородов
9. . . Серебрянская Нелля Александровна. Учитель МОУ «Образцовская СОШ». Фроловского муниципального района. Волгоградской области. Аннотация ...Свойства растворов электролитов
"Свойства растворов электролитов". Урок обобщения знаний с мультимедийным сопровождением.(слайд 1). Цели:. - обобщить, систематизировать и углубить ...Положение кислорода и серы в периодической системе химических элементов, строение их атомов. Озон – аллотропная модификация кислорода
Дата _____________ Класс ___________________. Тема: Положение кислорода и серы в периодической системе химических элементов, строение их атомов. ...Оксид серы (VI). Серная кислота и её соли
Дата_____________ Класс_______________. Тема: Оксид серы (VI). Серная кислота и её соли. Цели урока:. познакомить учащихся со свойствами серной ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:10 января 2019
Категория:Химия
Содержит:36 слайд(ов)
Поделись с друзьями:
Скачать презентацию