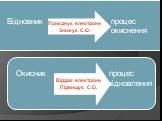
Презентация "Поняття про метод електронного балансу" по химии – проект, доклад
Презентацию на тему "Поняття про метод електронного балансу" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 7 слайд(ов).
Слайды презентации
Список похожих презентаций
Зеленая химия и проблемы устойчивого развития
• Атмосфера (загрязнение, фотохимический смог, кислотные выпадения, деградация озонового слоя, глобальное изменение климата) • Гидросфера (загрязнение, ...Презентація про мене
Закінчила Львівський Національний університет ім. І.Я. Франка Вчитель вищої категорії Вчитель – методист Стаж роботи: 30 років. 13.02.2019 Козі к ...М.В. Ломоносов и химия
- М.В. Ломоносов был создателем многих химических производств (неорганических пигментов, глазурей, стекла, фарфора). - Он разработал технологию и ...Незнайка в стране химия
Я – известный химик Незнайка. Я знаю все и все могу. Сейчас я взмахну волшебной палочкой и начнется извержение вулкана. Смотри! А теперь все за мной ...Коллоидная химия
Признаки объектов коллоидной химии. Поперечный размер частицы (а) – диаметр для сферических частиц (d) и длина ребра для кубических частиц (l). Дисперсность ...Кто ты и откуда химия?
Откуда пошло слов химия? Хи́мия (от араб. کيمياء, предположительно от египетского «chemi» — чёрный, откуда также греческое название Египта, чернозёма ...Откуда ты, химия ?
Химические элементы. Роберт Бойль – впервые дал определение химического элемента. Джон Дальтон – впервые ввёл понятие атомного веса. А.М.Бутлеров ...Кислород химия
Общая характеристика кислорода. Химический элемент Знак элемента – О Валентность – II Относительная атомная масса - 16. Простое вещество Неметалл ...Аналитическая химия
План доклада. Аналитическая химия (определение) Гармонизация терминологии по аналитической химии Роль терминологии Источники терминологии Цели и задачи ...Органическая химия "Жиры"
Рацион питания Белки Жиры Углеводы 2а, 2б 1 4б, 5. Роль жиров в здоровом питании спортсменов. Жиры хорошо усваиваются организмом, имеют высокую калорийность, ...алюминий химия
получение алюминия. Применение алюминия. ...Аналитическая химия
Определение. Аналити́ческая хи́мия — раздел химии, изучающий химический состав и структуру веществ; имеет целью определение элементов или групп элементов, ...Азот химия
План урока:. История открытия Цели Нахождение в природе Строение и свойства атома и молекулы Физические и химические свойства Получение и применение ...«Электролитическая диссоциация» химия
Электролитическая диссоциация. H2O. Процесс распада электролита на ионы при растворении его в воде или расплавлении называется электролитической диссоциацией. ...«Окислительно-восстановительные реакции» химия
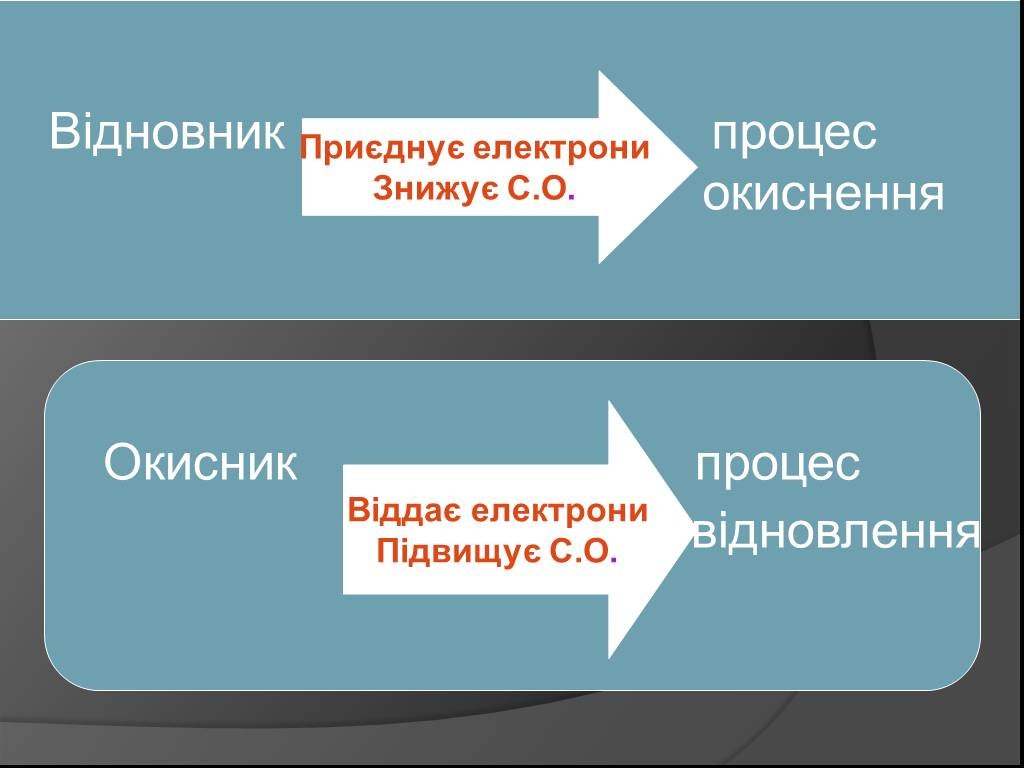
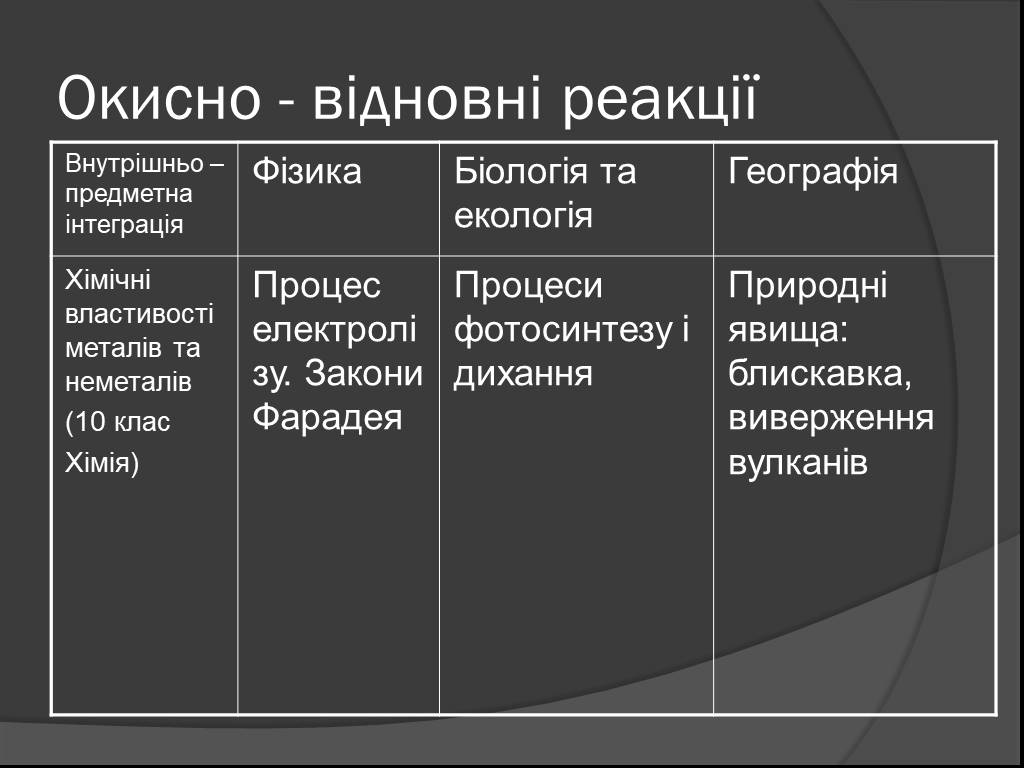
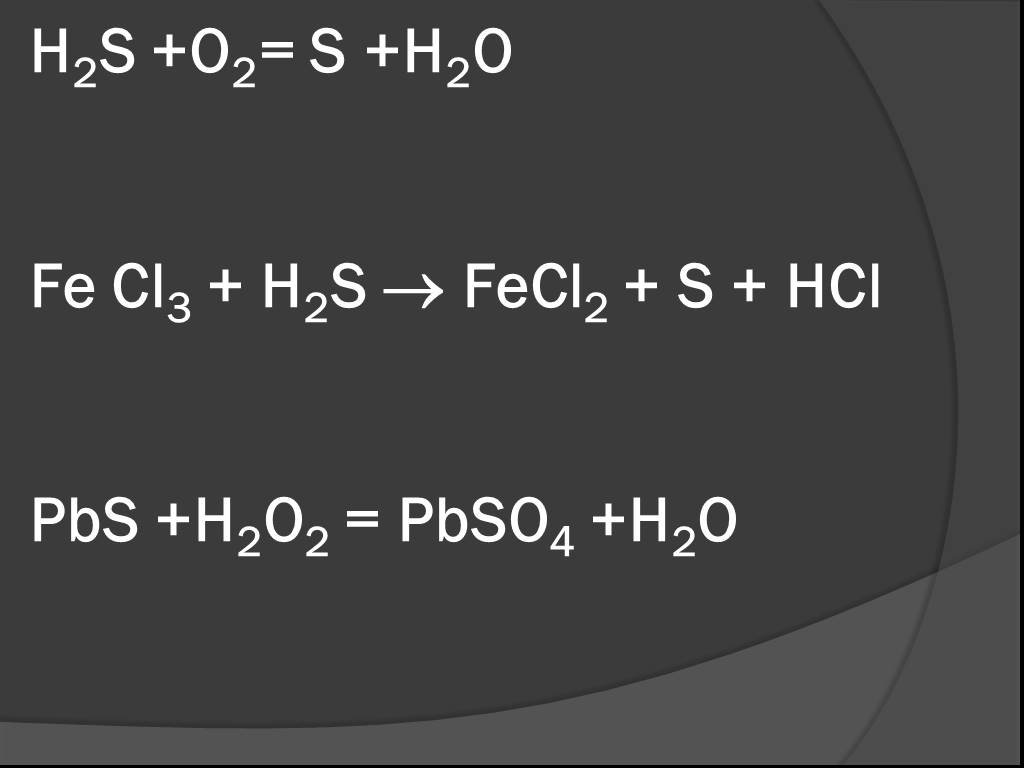
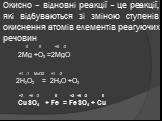
СОДЕРЖАНИЕ:. 1. Какие реакции называются окислительно-восстановительными? 2. Что называют окислителем, восстановителем? 3. Окислительно-восстановительный ...Органическая химия
история развития органической химии предмет органической химии особенности органических веществ Бутлеров теория строения органических соединений Бутлерова ...Аналитическая химия
Цель программы:. Фундаментальная подготовка магистрантов в области аналитической химии со знанием современных физико-химических методов анализа (хроматографических, ...Органическая химия
Органическая химия – химия углеводородов и их производных. Углеводороды (УВ) – простейшие органические вещества, молекулы которых состоят из атомов ...Белки химия
Содержание. Определение Функции белков Источники аминокислот Строение полипептидной цепи Структура белка Химические свойства Превращения белков в ...Органическая химия как наука
Содержание. Знакомство с историей возникновения науки органическая химия Органические вещества Схемы реакций Органическая химия Электронное строение ...Конспекты
Способы классификации химических элементов. Понятие про щелочные металлы и галогены
Тема:. . Способы классификации химических элементов. Понятие про щелочные металлы и галогены. . . Цель:. . Закрепить знания учащихся о ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:22 марта 2019
Категория:Химия
Содержит:7 слайд(ов)
Поделись с друзьями:
Скачать презентацию