Презентация "Получение и свойства алканов" по химии – проект, доклад
Презентацию на тему "Получение и свойства алканов" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 22 слайд(ов).
Слайды презентации
Список похожих презентаций
Получение и свойства алканов
ПОЛУЧЕНИЕ АЛКАНОВ:. ФРАКЦИОННАЯ ПЕРЕГОНКА НЕФТИ Нефть поступает в ректификационные колонны на атмосферную перегонку (перегонку при атмосферном давлении), ...Получение и свойства водорода
Как вы думаете , где используется водород? Каково практическое значение водорода? Где можно использовать знания по данной теме? Каковы цели урока? ...Получение и химические свойства кислорода
Цели и задачи урока:. Выяснить источник кислорода в природе; познакомиться с лабораторными и промышленными способами получения кислорода Познакомиться ...Алкены. Строение. Изомерия. Химические свойства. Получение
Элементный анализ этилена показывает, что в его состав входят примерно 87,5% углерода и 14,3% водорода. Плотность этилена по отношению к водороду ...Химические свойства алкенов. Получение
Прогноз реакционной способности алкенов. – наличие двойной связи позволяет отнести алкены к ненасыщенным соединениям. Превращение их в насыщенные ...Химические свойства и применение алканов
Цель урока. Образовательная: изучение химических свойств алканов, опираясь на их строение. Развивающая: продолжить формирование умения составлять ...Химические свойства бензола. Получение, применение
1. Дегидрирование циклоалканов. 2. Дегидроциклизация (ароматизация алканов): 3. Получение бензола тримеризацией ацетилена. 4. Сплавление солей ароматических ...Химические свойства алканов
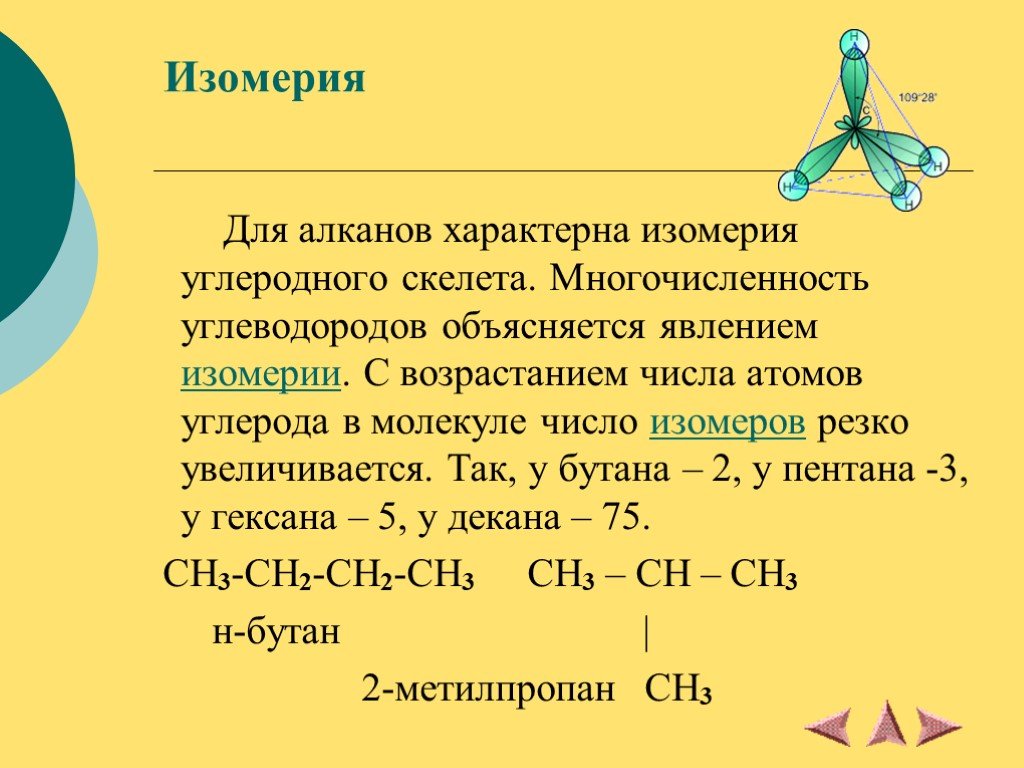
CnH2n+2. Химическая устойчивость алканов объясняется высокой прочностью б - связей С-С и С-Н, а также их неполярностью. Неполярные связи С-С и С-Н ...Альдегиды, свойства, получение, применение
Цели урока. Продолжить знакомить учащихся с кислородсодержащими органическими соединениями на примере альдегидов. Познакомить учащихся с применением ...Строение и свойства циклоалканов
Общая формула - СnH2n. Циклоалканы – это углеводороды, в которых все атомы углерода замкнуты в цикл. Строение и номенклатура циклоалканов. СН2 СН2 ...Получение алканов
А. В промышленности. Из природного сырья - нефти, газа Реакция Фишера-Тропша - синтез из оксида углерода (ІІ) и водорода, продукт смесь алканов: kat ...Физические свойства кислорода и его получение
Цели урока. Повторение. Новый материал. Тесты на закрепление. Рефлексия. Домашнее задание. Цели: - сформировать представление о кислороде; Задачи: ...Альдегиды получение, применение, физические и химические свойства
Парфюмерная продукция. Верхние ноты: бергамота, нероли, лимона Средние ноты: ландыша, ириса, жасмина Базовые ноты: мускуса, ванили, сандалового дерева. ...Кислород. Общая характеристика, получение и свойства
Химический элемент Знак элемента – О Относительная атомная масса – 16 Валентность – II. Кислород. Простое вещество Неметалл Молекула – О2 Относительная ...Кислород. Получение кислорода и его физические свойства
Цель. сформировать понятия кислород как атом и молекула; изучить физические и химические свойства кислорода, нахождение его в природе; рассмотреть ...Химические свойства и получение насыщенных одноатомных спиртов
Проверка домашнего задания Упражнение 5б. 1 2 3 Н3С – СН – СН3 1) | ОН 4 3 2 1 Н3С – СН2 – СН – СН2ОН 2) | СН3 ОН 1 2 3| 3) Н3С – СН2 – СН 4| 5 СН2 ...Соли: свойства, получение, применение
4. Что такое кислоты? 1. Какие классы веществ вы знаете? 2. Что такое оксиды? 3. Что такое основания? 5. Что такое основные оксиды, (кислотные оксиды)? ...Сложные эфиры. Жиры Строение, получение, свойства
Сложные эфиры. При взаимодействии карбоновых кислот со спиртами (реакция этерификации) образуются сложные эфиры: O O R1- C + R2 – OH R1- C +2H2O O ...Получение свекловичного сахара
Цель работы: получить сахар из красной свеклы. Сахароза находится во многих растениях, в том числе в моркови, дыне, кукурузе, клене, пальме и т.д. ...Получение натрия сульфата
Поскольку сульфат натрия - это соль, образованная сильным основанием NaOH и сильной кислотой H2SO4, ее раствор имеет показатель рН, близкий к нейтральному. ...Конспекты
Алканы. Гомологический ряд, изомеры, номенклатура, свойства и получение алканов Цели: Изучить алканы, как один из классов ациклических соединений
План учебного занятия №. 19. Дата Предмет. Химия. группа. Ф.И.О. преподавателя: Кайырбекова И.А. . Тема. :. Алканы. Гомологический ряд, изомеры, ...Азотная кислота и ее свойства, получение и применение. Соли азотной кислоты
Тема: «Азотная кислота и ее свойства, получение и применение. Соли азотной кислоты» (урок – исследование). Цели урока. Образовательная:. ...Получение и свойства соединений металлов
Муниципальное общеобразовательное учреждение лицей. Технологическая карта урока по химии. Практическая работа. «Получение и свойства соединений ...Практическая работа № 1 Получение и свойства соединений металлов
Лысоконь Ирина Алексеевна. МБОУ СОШ № 2 ст. Архонская Пригородного района РСО-Алания. Учитель химии. Тема урока: Практическая работа № 1 Получение ...Положение азота и фосфора в периодической системе химических элементов, строение их атомов. Азот, физические и химические свойства, получение и применение
Дата_____________ Класс_______________. Тема:. . Положение азота и фосфора в периодической системе химических элементов, строение их атомов. Азот, ...Получение и свойства кислорода
ТЕХНОЛОГИЧЕСКАЯ КАРТА МОДУЛЬНОГО УРОКА. ". Получение. и свойства. кислорода " (8 класс). Учебные. элементы. Дидактические цели. . Руководство ...Кислоты: состав, номенклатура, классификация, свойства, получение. Индикаторы. Реакция нейтрализации. Понятие о кислотных дождях
Урок химии в 8 классе. Тема:. Кислоты: состав, номенклатура, классификация, свойства, получение. Индикаторы. Реакция нейтрализации. Понятие о кислотных ...Насыщенные одноатомные спирты: состав, строение, свойства, получение
Урок химии в 11 классе. Тема урока. . Насыщенные одноатомные спирты: состав, строение, свойства, получение. Тип урока. : изучение нового материала. ...Кислород, его общая характеристика. Нахождение в природе.Получение и свойства кислорода
Урок химии в 8 классе «Кислород, его общая характеристика. Нахождение в природе.Получение и свойства кислорода». Цель: . изучение и первичное осознание ...Кислород: строение, свойства, получение и применение
Подготовил: Капитаненко В. П. Учитель химии. МБОУ «Беляевская СОШ». Урок по теме: «Кислород: строение, свойства, получение и применение». ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:3 ноября 2018
Категория:Химия
Содержит:22 слайд(ов)
Поделись с друзьями:
Скачать презентацию